O envelhecimento sempre foi considerado um processo inevitável.
Mas a descoberta de que o próprio processo de envelhecimento poderia ser “hackeado” levou ao conceito de “longevidade”, em oposição a apenas “longevidade”.
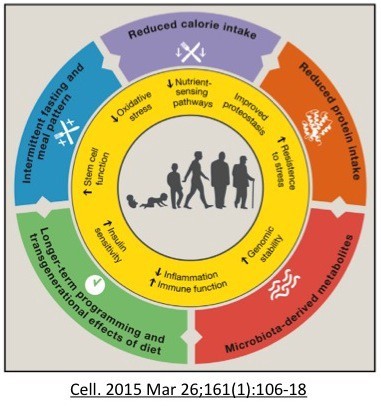
Uma vida longa não é necessariamente prejudicada por deficiência e morte, e intervenções dietéticas específicas, em particular, podem promover uma vida longa e saudável.
No entanto, muitos desses dados resultam de dados de animais, pois é difícil fazer experimentos em humanos vivos.
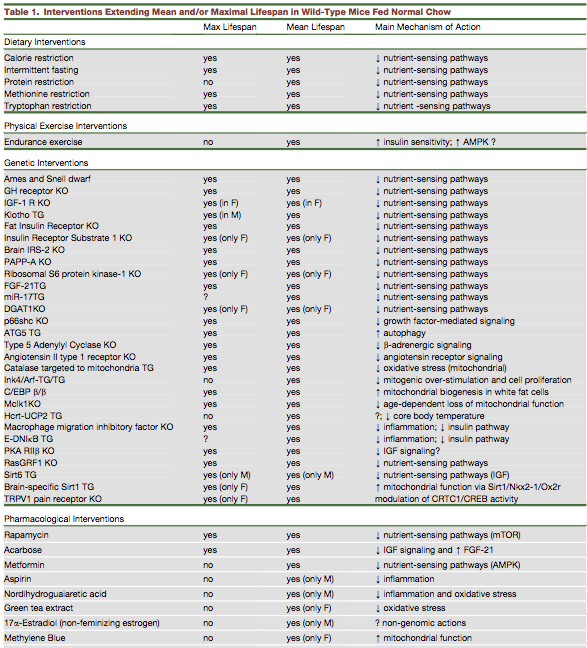
A tabela abaixo ilustra os resultados das intervenções dietéticas, de exercícios, genéticas e medicamentosas e seu principal mecanismo de ação. Preste atenção especial à coluna ‘Mains Machanism action!.
Esta é a melhor estimativa de como todas essas diferentes intervenções podem aumentar a expectativa de vida.
Você notou que quase todas as intervenções funcionam através do mesmo caminho? - diminuição da detecção de nutrientes - que também inclui diminuição da sinalização do fator de crescimento e autofagia aumentada.
Os 3 principais sensores de nutrientes do corpo humano, semelhante à maioria dos animais são:
- mTOR (mammalian target of rapamycin)
- AMPK (AMP-activated protein kinase)
- Insulina
A maioria dessas intervenções da tabela acima afeta uma ou mais dessas vias.
O alvo da rapamicina (TOR – Target of Rapamycin) é uma proteína quinase de detecção de nutrientes conservada de forma evolutiva que regula o crescimento e o metabolismo em todas as células eucarióticas.
Estudos em moscas, vermes, leveduras e camundongos suportam a noção de que a rede de sinalização TOR modula o envelhecimento. TOR também está emergindo como um robusto mediador dos efeitos protetores de várias formas de restrição dietética, que pode prolongar a vida útil e retardar o aparecimento de certas doenças relacionadas à idade entre as espécies.
Identificar os mecanismos pelos quais a rede de sinalização TOR funciona como um marcapasso do envelhecimento é um grande desafio e pode ajudar a identificar potenciais alvos de drogas para doenças relacionadas à idade. Sabe-se atualmente, que o bloqueio do mTOR melhora a manipulação de proteínas, aumenta a autofagia e melhora a função das células estaminais.
Ou seja, a partir de todo conhecimento obtido com a pesquisa animal, concluímos que o aumento da duração da vida saudável não depende de se ter mais nutrientes, e sim de se ter menos!
O aumento da longevidade depende da diminuição dos sensores de nutrientes (menos mTOR e insulina, maior AMPK) pelo menos periodicamente. Isso é fascinante, porque a intervenção dietética mais antiga é o jejum – uma forma clara de diminuir as vias de detecção de nutrientes.
Os seres humanos já usavam o jejum (ou limpeza, desintoxicação, purificação ou o como você quiser chamar) como um método para aumentar o bem-estar, desde a antiguidade. Benjamin Franklin, jornalista, editor, autor, filantropo, político, abolicionista, funcionário público, cientista, diplomata e inventor, disse: “O melhor de todos os medicamentos é descansar e jejuar”
“a partir de todo conhecimento obtido com a pesquisa animal, concluímos que o aumento da duração da vida saudável não depende de se ter mais nutrientes, e sim de se ter menos!”
Jejum faz suas células “se comerem” e isso te renova, diz Nobel de Medicina 2018
Os cientistas estão pesquisando como o jejum ou o corte radical de calorias pode promover o aumento da expectativa de vida.
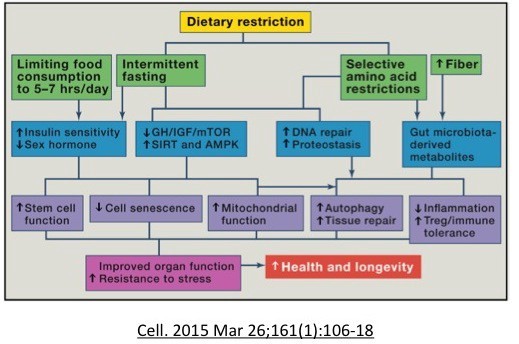
A alimentação equilibrada e rica em nutrientes é fundamental para uma boa saúde. Porém, já é sabido que a privação de alimentos de forma controlada pode ativar mecanismos de autodefesa das células que garantem a elas maior longevidade.
É isso que se traduz em benefícios para todo nosso organismo. Tudo por causa da autofagia. Ela é um mecanismo importante de autolimpeza que existe em todas as células de nosso corpo. Os genes que regulam essa reciclagem de organelas velhas ou malformadas foram identificados por Yoshinori Ohsumi, ganhador do Nobel de medicina deste ano.
A autofagia é ativada quando a célula está em situações de estresse.
Por exemplo, quando o indivíduo deixa de se alimentar. Para sobreviver, a célula passa a “comer” partes internas, degradando tudo o que tem de ruim. Quanto mais o mecanismo funciona maior a faxina interna.
“A autofagia é ativada quando a célula está em situações de estresse, como no jejum”
“Que o jejum induz a autofagia, isso é sabido. Também sabemos que a autofagia induz a longevidade. A busca agora é a compreensão da conexão entre a autofagia ativada pelo jejum e a longevidade das células”, explica Soraya Smaili, professora livre-docente da Escola Paulista de Medicina. A redução da autofagia leva ao acúmulo de componentes danificados, o que está associado à morte das células e ao desenvolvimento de doenças. Assim, manter o mecanismo ativo seria uma forma de prevenir problemas futuros.
“a redução da autofagia leva ao acúmulo de componentes danificados, o que está associado à morte das células e ao desenvolvimento de doenças”
AMPK INDUZ BIOGÊNESE MITOCONDRIAL
Além disso, há uma clara correlação entre o melhor funcionamento das mitocôndrias e diminuição dos sensores de nutrientes.
A mitocôndria é a fonte de força das células e é óbvio que as células precisam ter força para funcionarem corretamente.
A proteína AMPK (5′ AMP-activated protein kinase) é reguladora da homeostase de energia e liga a questão energética ao envelhecimento. A AMPK é uma espécie de “indicadora de combustível reverso” da célula. O ATP é a molécula que transporta energia para células depois que nos alimentamos. Quando esse nível fica baixo, a AMPK aumenta. A AMPK induz a biogênese mitocondrial (criação de novas mitocôndrias), além de regular o metabolismo e a dinâmica mitocondrial.
Em um estudo de 2017, Weir e colaboradores demonstram que a AMPK pode manter a morfologia da rede mitocondrial juvenil mesmo com o envelhecimento.
Quando expuseram animais ao jejum intermitente, houve uma mudança marcante nas redes mitocondriais. Este estudo de Weir e colaboradores destaca o papel fundamental que a restrição alimentar pode ter no aumento da vida útil ao afetar as redes mitocondriais. As mitocôndrias são parte de redes que podem se fundir (fusão) ou separar (fissão) em constante remodelação.
Uma desregulação dessas dinâmicas mitocondriais e morfologia anormal dessas mitocôndrias são características do envelhecimento e acredita-se que contribuam para muitas doenças degenerativas, como Alzheimer e Parkinson. Com a idade, muitos estudos relatam um aumento das mitocôndrias inchadas e fragmentadas.
A Mitofagia, um processo de degradação e reciclagem da mitocôndria danificada, desempenha um papel importante na manutenção da dinâmica normal. Se isso for verdade para os seres humanos, as intervenções dietéticas são a chave para a longevidade. Isso reorientou a atenção para a frequência da refeição, tempo e jejum intermitente.
Durante a nossa história evolutiva, a maioria dos grandes animais e humanos comeram apenas intermitentemente.
Longos períodos de fome eram normais, seja devido a mudanças sazonais ou devido a eventos climáticos episódicos.
Muitos animais desenvolveram formas de repouso em resposta à escassez de alimentos. Se o alimento não estivesse disponível, a maioria das células em nosso corpo deixa de crescer. Importante, os mesmos genes que controlam a quiescência também controlam a vida útil.
Em roedores, o jejum de 24 horas a cada dois dias ou duas vezes por semana prolonga a vida útil até 30%. A restrição calórica crônica também pode ter benefícios semelhantes. O jejum pode promover a função mitocondrial, desencadear a autofagia e as vias de reparo do DNA.
Mas o que é mais controverso é se os benefícios se relacionam com a restrição calórica em geral, ou se relaciona com nutrientes específicos.
Estudos originais de 1985 sugeriram que eram calorias, e não proteínas. No entanto, um ponto negligenciado originalmente era que esses animais não tinham alimentação restrita.
Estudos subsequentes apontaram especificamente para a restrição de proteínas como a chave para a longevidade nestes estudos em animais.
A maioria acredita que isso se deve ao efeito regulatório chave da proteína dietética no mTOR e no IGF1. Nos seres humanos, ao contrário dos roedores, a restrição calórica severa não reduz a concentração sérica de iGF-1, a menos que a ingestão de proteína também seja reduzida.
São todas as proteínas ou apenas certos aminoácidos?
A resposta não é conhecida. Em estudos com animais, o aminoácido específico que é crítico difere entre as espécies. Nos seres humanos, os aminoácidos de cadeia ramificada parecem ser um ativador particularmente forte do mTOR.
“os aminoácidos de cadeia ramificada parecem ser ativadores particularmente fortes do mTOR”
Sensores diminuídos de nutrientes
Comparado com outras intervenções dietéticas, o jejum intermitente parece ser muito mais poderoso, porque sozinho tem a capacidade de afetar todos os 3 sensores de nutrientes ao mesmo tempo, além de estimular autofagia e mitofagia. O mTOR é sensível à proteína dietética. A insulina é sensível às proteínas e aos carboidratos. Portanto, comer uma dieta de gordura pura (não realista) pode baixar mTOR e insulina, mas não será capaz de aumentar a AMPK, pois isso detecta o estado de energia das células. Se você come uma dieta muito alta em gordura (cetogênica), seu corpo ainda será capaz de metabolizar isso para ATP gerador de energia e reduzir a AMPK.
Apenas 2 dos 3 percursos de detecção de nutrientes foram alertados. Apenas a restrição completa dos nutrientes (ou seja, jejum) terá o efeito esperado.
Teoricamente, comer com menos frequência pode melhorar significativamente a saúde. A maioria dos mamíferos onívoros come somente intermitentemente, já que tendemos a não viver em uma placa de Petri onde os nutrientes estão constantemente disponíveis. Carnívoros como leões e tigres costumam comer uma vez por semana ou menos. Os seres humanos ancestrais tendiam a comer intermitentemente dependendo da disponibilidade de alimentos.
“Ser capaz de funcionar em um nível elevado, tanto fisicamente como intelectualmente, por períodos de jejum prolongados era fundamentalmente importante para a sobrevivência”
Isso explica nossos sistemas bem desenvolvidos de armazenamento de alimentos (glicogênio no fígado e gordura corporal) e também nossos sensores de nutrientes altamente conservados para diminuir o crescimento celular durante um período de baixa disponibilidade de nutrientes.
As coisas mudaram um pouco com a revolução agrícola há aproximadamente 10.000 anos. De uma sociedade de caçadores-coletores, a agricultura permitiu que as populações de seres humanos permanecessem em uma área e tivessem uma disponibilidade de alimentos mais estável.
No entanto, ainda haveria variação sazonal e possivelmente longas semanas ou meses em que os alimentos estariam menos disponíveis. Também haveria períodos de tempo mais curtos, dias – semanas, onde a comida era restrita.
“A maioria dos seres humanos comia entre 2-3 vezes por dia.
Sem luz, seria difícil comer um lanche da “meia-noite” na escuridão. Assim, os primeiros humanos ainda seguiram a tradição de um longo período de jejum durante a noite – daí o termo break-fast“
Diferentes sensores de nutrientes são sensíveis a diferentes durações do tempo. Ou seja, seria útil para o nosso corpo saber se os nutrientes eram restritos a curto prazo (durante a noite) nas durações médias (dias) ou longas durações (semanas-meses, estações).
Você pode ver que nosso corpo humano desenvolveu exatamente essas mesmas capacidades em nossos sensores de nutrientes.
- Insulina; tempo para ser ativada:curto prazo
- mTOR; tempo para ser ativada: dias
- AMPK, tempo para ser ativada: semanas
Picos de insulina ocorrem rapidamente após uma refeição, mas caem tão rapidamente durante um jejum à noite. Eles respondem principalmente a carboidratos e proteínas. Enquanto a proteína não aumenta a glicemia, ela aumenta bastante a insulina.
Ela também aumenta o glucagon, de modo que a glicose no sangue permanece estável. O mTOR é principalmente sensível a proteínas e particularmente aminoácidos de cadeia ramificada. Não cai tão rapidamente e leva algo em torno de 18 a 30 horas para ativar. A AMPK é a indicadora de combustível reverso da célula e só aumenta com a privação de energia prolongada.
Podemos começar a recuperar a nossa antiga sabedoria perdida, seguindo a tradição alimentar antiga de tirar uma pausa de comer de vez em quando. Dê uma chance de digerir o alimento que você comeu.
Jejum intermitente!!!
REFERÊNCIAS
Longevity and Diet
https://medium.com/personal-growth/longevity-and-diet-9b5011afc22
With TOR, less is more: a key role for the conserved nutrient-sensing TOR pathway in aging.
https://www.ncbi.nlm.nih.gov/pubmed/20519118
Dietary Restriction and AMPK Increase Lifespan via Mitochondrial Network and Peroxisome Remodeling.
https://www.ncbi.nlm.nih.gov/pubmed/29107506
Jejum faz suas células se comerem; e isso te renova, diz Nobel de medicina.
Amino acid imbalance explains extension of lifespan by dietary restriction in Drosophila
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2798000/
The ratio of macronutrients, not caloric intake, dictates cardiometabolic health, aging, and longevity in ad libitum-fed mice.
https://www.ncbi.nlm.nih.gov/pubmed/24606899
Comparative and meta-analytic insights into life extension via dietary restriction.